Leukämie
 Leukämie ist eine Form von Blutkrebs, die durch ein krankhaftes Wachstum von Blutzellen verursacht wird. Es wird allgemein mit Kindern in Verbindung gebracht, da es eine der wenigen Krebsarten ist, die regelmäßig bei Kindern auftritt, auch wenn Leukämie bei älteren Menschen viel häufiger ist. Bei ungefähr 350 000 Menschen wird jedes Jahr Leukämie diagnostiziert und es gibt jährlich 250 000 Fälle mit TodesfolgeANCHOR.
Leukämie ist eine Form von Blutkrebs, die durch ein krankhaftes Wachstum von Blutzellen verursacht wird. Es wird allgemein mit Kindern in Verbindung gebracht, da es eine der wenigen Krebsarten ist, die regelmäßig bei Kindern auftritt, auch wenn Leukämie bei älteren Menschen viel häufiger ist. Bei ungefähr 350 000 Menschen wird jedes Jahr Leukämie diagnostiziert und es gibt jährlich 250 000 Fälle mit TodesfolgeANCHOR.
Bei den meisten Leukämiefällen handelt es sich entweder um myeloische oder um lymphatische Leukämie. Die myeloische Leukämie befällt die myeloische Zellen, die die roten Blutzellen (früher: Blutkörperchen) bilden, die lymphatischen Leukämie die lymphatischen Zellen, die die weißen Blutzellen (früher: Blutkörperchen) bilden. Beide Arten können entweder akut, wobei ein rapider Anstieg anormaler, unreifer weißer Blutzellen im Knochenmark zu einer Verdrängung normaler Blutzellen führt, oder chronisch sein, wobei der Anstieg langsamer ist und hauptsächlich aus voll ausgereiften Blutzellen besteht. Die am häufigsten vorkommenden Arten der Leukämie sind die akute myeloische Leukämie und die chronische lymphatische Leukämie, mit jeweils etwa 30% der Fälle. Ungefähr 17% der Leukämie Fälle fallen nicht unter diese Kategorien.
Anders wie die meisten anderen Krebsarten, wird Leukämie oft durch gut erforschte, relativ einfache genetische Mutationen verursacht. Diese Tatsache hat es den Forschern ermöglicht Behandlungsmethoden zu entwickeln, die das Schicksal der Patienten dramatisch verbessert haben, auch wenn dies abhängig vom Krankheitstyp stark variiert.
Akute myeloische Leukämie (AML)
Chronische myeloische Leukämie (CML)
Akute lymphatische Leukämie (ALL)
Chronische lymphatische Leukämie (CLL)
Quellen
Acute myeloid leukaemia
Die 5-Jahres-Überlebensrate für AML liegt bei der am häufigsten betroffenen Altersgruppe von über 65 Jahren, bei weniger als 10%. Es ist ähnlich wie bei lokalen Krebstumoren, wie Brust- oder Darmkrebs, wo jeder Patient und sogar jede Zelle eine unterschiedliche Kombination aus Dutzenden von Mutationen beherbergt. Es ist diese Vielfältigkeit, die AML im Vergleich zu anderen Arten von Leukämie so schwer zu behandeln macht.
Die Standard Behandlungsmethode ist Chemotherapie in Kombination mit Stammzellentransplantation, die bei gesünderen Patienten möglich ist.
Heute arbeiten Wissenschaftler an einem ganz anderen Weg den Krebs zu besiegen. Seit den 1960er Jahren haben die Wissenschaftler bemerkt, dass es bei Leukämie-Patienten zu sonderbaren Mustern der DNA-Methylierung kommt. Methylierung ist der Prozess durch den ein chemischer Marker in Form einer Methyl-Gruppe an die DNA geheftet wird. Dies kann weitreichende Auswirkungen haben und kontrolliert effektiv ob das Gen an- oder ausgeschaltet wird. Diese Form der Steuerung wird als Epigenetik bezeichnet.
Im Jahr 2004 wurde das erste Medikament zugelassen, das auf epigenetischer Ebene ansetzt um Leukämie bei Patienten zu verhindern, die am Myelodysplastischen Syndrom leiden, einer nicht-aggressiven Form von Krebs, die sich allerdings in einem Drittel der Fälle zu AML entwickeltANCHOR. Sowohl der Wirkstoff 5-Azacytidin (Handelsname: Vidaza) als auch Decitabin (Handelsname: Dacogen) beeinflussen die DNA-Methylierung.
Bei dem Versuch andere Angriffsmöglichkeiten für ähnliche epigenetische Medikamente zu finden, durchsuchten Wissenschaftler eine Datenbank von RNA Molekülen, die für die Blockade der Aktivität epigenetischer Regulator-Proteine bei einem Maus-Modell von AML konzipiert sindANCHOR. Sie entdeckten dabei, dass besonders das Protein Brd4 wesentlich für die Aufrechterhaltung der Krebszellen ist. Anhand des Wirkstoffes JQ1, der bereits zuvor entwickelt worden war um Brd4 zu blockieren, konnte gezeigt werden, dass es gegen eine Reihe von Untertypen von AML wirkt. Brd4 funktioniert indem es epigenetische Marker, bekannt als Acetyl-Gruppen „liest“ und anderen an der DNA Steuerung beteiligten Proteinen entsprechende Rückmeldung liefert.
Im Jahr 2008 wurde erstmals das Genom eines AML-Patienten sequenziert, was die Hoffnung auf zukünftige zielführende Therapien erweckte. Seitdem haben die Fortschritte auf dem Gebiet der DNA-Sequenzierung dieses Potenzial stark vergrößert. 2013 publizierten Wissenschaftler Ergebnisse über die DNA-Sequenzierung von 200 Erwachsenen mit AMLANCHOR. Dies enthüllte, dass bei mehr als Dreivierteln von ihnen eine krankhafte Mutation in einem epigenetischen Enzym vorlag. Diese Enzyme sind dafür verantwortlich chemische Marker an DNA Moleküle und an Proteine, die im Zusammenhang mit der DNA stehen, anzubringen und zu entfernen. Durch diese Marker wird die An- und Ausschaltung dieser Gene gesteuert. Für mehrere dieser Enzyme, darunter DNMT3A, IDH1, IDH2, DOT1L und TET2, werden jetzt Medikamente entwickelt.
Chronische myeloische Leukämie (CML)
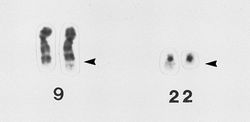 Im Jahr 1960 entdeckten Forscher, dass bei 95% der Patienten mit chronischer myeloischer Leukämie (CML) eine Anomalität in den Chromosomen der Krebszellen vorliegt. Diese ist seitdem, benannt nach der Stadt ihrer Entdeckung, als Philadelphia-Chromosom bekanntANCHOR. Später wurde klar, dass diese Anomalie zustande kommt, wenn Teile der Chromosomen 9 und 22 bei der Replikation vertauscht werden, wodurch dann genetische Fusionen entstehen, die BCR und ABL genannt werdenANCHOR. Es war unklar, ob dies die Ursache für den Krebs oder eine Auswirkung des Krebses war, bis Forscher das fusionierte BRC-ABL Gen in Mäuse schleusten und dieses zu einem CML ähnlichen Krankheitsbild führteANCHOR ANCHOR ANCHOR ANCHOR. Diese Ergebnisse führten zu Arbeiten deren Ziel es war die Aktivität dieses Gens zu unterbinden.
Im Jahr 1960 entdeckten Forscher, dass bei 95% der Patienten mit chronischer myeloischer Leukämie (CML) eine Anomalität in den Chromosomen der Krebszellen vorliegt. Diese ist seitdem, benannt nach der Stadt ihrer Entdeckung, als Philadelphia-Chromosom bekanntANCHOR. Später wurde klar, dass diese Anomalie zustande kommt, wenn Teile der Chromosomen 9 und 22 bei der Replikation vertauscht werden, wodurch dann genetische Fusionen entstehen, die BCR und ABL genannt werdenANCHOR. Es war unklar, ob dies die Ursache für den Krebs oder eine Auswirkung des Krebses war, bis Forscher das fusionierte BRC-ABL Gen in Mäuse schleusten und dieses zu einem CML ähnlichen Krankheitsbild führteANCHOR ANCHOR ANCHOR ANCHOR. Diese Ergebnisse führten zu Arbeiten deren Ziel es war die Aktivität dieses Gens zu unterbinden.
Nach erfolgreichen Versuchen sowohl an Mäusen als auch an Zellkulturen, wurde 1996 ein BCR-ABL-Hemmer entwickelt, der später unter dem Namen Imatinib bekannt wurdeANCHOR. Frühe klinische Studien zeigten, dass es sich um einen bemerkenswerten Arzneistoff handelt, der bei allen Patienten zur Remission führte. 2001 wurde Imatinib zugelassen und unter dem Handelsnamen Gleevec oder Glivec verkauft. Dies war ein Wendepunkt in der Behandlung von CML Patienten und die Lebenserwartung von Patienten stieg durch Imatinib und ähnliche Medikamente von zuvor 5 bis 6 Jahre auf 10 bis 20 Jahre.
Auch wenn Imatinib sehr wirksam ist, werden Resistenzen oft zum Problem. Schon in frühen Stadien der Krankheit, kann es zu hoher genetische Instabilität kommen, was die Bildung neuer Mutationen begünstigt. Studien An Mäusen legen nahe, dass das BCR-ABL Protein selbst diese Instabilität begünstigtANCHOR. Nach acht Jahren, müssen etwa die Hälfte der Patienten auf andere Medikamente umsteigen, da Imatinib unwirksam geworden istANCHOR. Glücklicherweise gibt es mehrere Alternativen, darunter Dasatinib, Nilotinib, Bosutinib und Pontinib (zugelassen im Dezember 2012), so dass man mehrere resistente Mutationen umgehen kann.
Akute lymphatische Leukämie (ALL)
Akute lymphatische Leukämie (ALL) tritt hauptsächlich bei Kindern auf und ist für 75% der Leukämiefälle im Kindesalter verantwortlich. In den 1970er Jahren starben ungefähr zwei Drittel der jungen PatientenANCHOR, aber im Jahr 2005 konnte man Neunzig Prozent der erkrankten Kinder unter 15 Jahren heilenANCHOR.
Aminopterin wurde 1948 erstmals auf dem Markt eingeführt und es entwickelte sich zum ersten bekannten Wirkstoff, der das Wachstum von Krebs hemmen konnteANCHOR. Es konnte bei ALLEN Kindern eine temporäre Besserung (Remission) erwirken. Aminopterin ist ein Antifolat, also ein Folsäure-Hemmstoff, was bedeutet, dass es alle metabolischen Abläufe an denen Folsäure (Vitamin B9) beteiligt ist blockiert. Insbesondere verlangsamt es das Wachstum des Rückenmarks, wodurch die Leukämie in Remission geht.
Ein Jahr nachdem Aminopterin nachgewiesen wurde, konnte gezeigt werden, dass ein ähnliches Antifolat, Methotrexat genannt, bei Ratten zu einem Rückgang der weißen Blutkörperchen führtANCHOR und dass es bei Mäusen mit Leukämie die Lebenserwartung verbessertANCHOR. Methotrexat löste später Aminopterin in seiner Rolle als Medikament der Wahl ab, nachdem Versuche an Mäusen zeigten, dass es weniger Nebenwirkungen hatANCHOR.
Ungefähr 20% ALLER Patienten haben das Philadelphia-Chromosom und können deshalb auch mit Imatinib und ähnlichen Medikamenten behandelt werden.
Normalerweise werden Patienten mit Chemotherapie behandelt um den Krebs in die Remission zu zwingen, was die Anzahl der Krebszellen im Körper drastisch reduziert. Nur einige wenige zurück bleibende Krebszellen können dem Krebs jedoch bereits die Rückkehr ermöglichen. Hoch dosierte Chemotherapie oder die Ganzkörperbestrahlung (TBI) trägt zwar dazu bei beinahe alle Krebszellen zu zerstören, kann aber auch die blutbildenden Stammzellen im Knochenmark vernichten. Deshalb muss im Anschluss an eine solche Behandlung eine Stammzellen- oder Knochenmarkstransplantation von einem Spender stattfinden, um die verlorenen Zellen zu ersetzen.
Im Jahr 1985 wurde erstmals eine Knochenmarkstransplantation durchgeführt um Leukämie zu heilen. Seit dem hat die Wissenschaft auch Knochenmarks- und Stammzellentransplantate von Spendern, die keine vollständige Übereinstimmung mit dem Empfänger haben, möglich gemacht, was die Anwendbarkeit solcher Therapien deutlich verbessert hat.
Nach Versuchen an Zebrafischen konnte gezeigt werden, dass für die Entwicklung von blutbildenden Stammzellen zirkulierendes Blut notwendig ist. Forscher testeten über 2000 Wirkstoffe an Zebrafischen um ihre Auswirkungen auf die Entwicklung von Stammzellen zu untersuchen und fanden heraus, dass diejenigen, die die Blutzirkulation anregten mit erhöhter Stammzellenproduktion einher gingenANCHOR. Spätere Versuche zeigten ähnliche Effekte bei Mäusen und man konnte die Ergebnisse bestätigen indem man Flüssigkeiten über Stammzellen in Zellkulturen fließen ließ. Man hofft, dass diese Medikamente die Genesung von Patienten nach dem Erhalt von Stammzellentransplantaten begünstigen können.
Chronische lymphatische Leukämie (CLL)
CLL kann mit Chemotherapie und monoklonalen Antikörpern behandelt werden. Es hat eine 5-Jahres-Überlebensrate von ungefähr 80%.
Einige dieser spannenden aktuellen Fortschritte basieren darauf, dass man die T-Zellen des Patienten so umprogrammiert, dass sie den Krebs angreifen und zerstören. Eine Probe der T-Zellen kann genetisch so modifiziert werden, dass die Zellen chimärische Antigen Rezeptoren produzieren (CAR) die es ihnen ermöglichen sich im Körper schnell zu replizieren und B-Zellen anzugreifenANCHOR ANCHOR. Diese Rezeptoren besteht aus einem Antikörper, der aus einem monoklonalen Antikörper der Maus abgeleitet wurde und dafür designt wurde B-Zellen zu erkennenANCHOR. Das zerstört alle B-Zellen des Patienten, ob gesund oder verkrebst, was ernste Nebenwirkungen hat, aber auch einschlägige Ergebnisse bei der Behandlung von Krebs liefert, dem die Chemotherapie nichts anhaben konnte. Im Moment steht diese Behandlungsmethode nur in kleinen Versuchsreihen zur Verfügung, und eine kritische Herausforderung wird es sein, sie so auszuweiten, dass sie einer größeren Patientengruppe zur Verfügung steht.
Diese Technologie wurde über mehrere Jahrzehnte hinweg entwickelt: von der Modifikation von auf Zellen der Maus basierenden HybridomzellenANCHOR ANCHOR, bis zur Möglichkeit der direkten Modifikation der T-Zellen, die von Mäusen oder sogar einem Patienten stammenANCHOR ANCHOR. Der erste Nachweis über eine menschlichen CAR T-Zelle, die Krebs zurück drängte wurde im Jahr 2002 anhand von Mäusen erbrachtANCHOR. Seitdem hat diese Technik positive Ergebnisse in klinischen Versuchsreihen an CLL Patienten erzieltANCHOR und wurde zur Behandlung von rückfälligen ALL Patienten eingesetztANCHOR.
Quellen
- Lozano R (2012) Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 Lancet 380(9859): 2095–128 doi:10.1016/S0140-6736(12)61728-0
- Kaminskas E, Farrell AT, Wang Y-C, Sridhara R, Pazdur R (2005) FDA Drug Approval Summary: Azacitidine (5-azacytidine, Vidaza) for Injectable Suspension The Oncologist 10(3):176–182 doi:10.1634/theoncologist.10-3-176
- Zuber J et al (2011) RNAi screen identifies Brd4 as a therapeutic target in acute myeloid leukaemia Nature 478, 524–528 doi: 10.1038/nature10334
- The Cancer Genome Atlas Research Network (2013) New England Journal of Medicine 368, 2059-2074
- Nowell P, Hungerford D (1960) A minute chromosome in chronic granulocytic leukemia Science 132(3438):1497 doi: 10.1126/science.132.3438.1488
- Rowley JD (1973) A New Consistent Chromosomal Abnormality in Chronic Myelogenous Leukaemia identified by Quinacrine Fluorescence and Giemsa Staining Nature 243, 290-293 doi:10.1038/243290a0
- Daley GQ, Van Etten RA, Baltimore D (1990) Induction of chronic myelogenous leukemia in mice by the P210 BCR-ABL gene of the Philadelphia chromosome Science 247, 824–830
- Elefanty AG, Hariharan IK, Cory S (1990) BCR-ABL, the hallmark of chronic myeloid leukaemia in man, induces multiple haemopoietic neoplasms in mice. EMBO J. 9, 1069–1078
- Heisterkamp N et al. (1990) Acute leukaemia in bcr/abl transgenic mice Nature 344:251-253
- Kelliher MA et al (1990) Induction of a chronic myelogenous leukaemia-like syndrome in mice with v-abl and BCR-ABL Proc Natl Acad Sci USA 87, 6649-6653
- Druker BJ et al. (1996) Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells Nature Medicine 2, 561–566 doi:10.1038/nm0596-561
- Salloukh HF, Laneuville P (2000) Increase in mutant frequencies in mice expressing the BCR-ABL activated tyrosine kinase. Leukemia 14, 1401–1404
- Marin D et al (2012) Assessment of BCR-ABL1 Transcript Levels at 3 Months Is the Only Requirement for Predicting Outcome for Patients With Chronic Myeloid Leukemia Treated With Tyrosine Kinase Inhibitors J Clin Oncol 30, 232-238 DOI: 10.1200/JCO.2011.38.6565
- Steliarova-Foucher E, Stiller C, Kaatsch P et al (2004) Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCIS project): an epidemiological study Lancet 364:2097–2105
- Hunger SP et al (2012) Improved Survival for Children and Adolescents With Acute Lymphoblastic Leukemia Between 1990 and 2005: A Report From the Children's Oncology Group. Journal of Clinical Oncology
- Farber S, Diamond LK (1948) Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4-aminopteroyl-glutamic acid. N Engl J Med. 238(23):787-93
- Franklin A, Belt M, Stoksstad E & Jukes T (1949) J Biol Chem 177, 621-629
- Burchenal J, Johnson S, Burchenal JR, Kushida M, Robinson E & Stock C (1949) Proc Soc Exper Biol Med 71, 381- 387
- Goldin A, Venditti JM, Humphreys SR, Dennis D, Mantel N, Greenhouse SW (1955) A quantitative comparison of the antileukemic effectiveness of two folic acid antagonists in mice J. Natl. Cancer Inst. 15 (6): 1657–64.
- North TE et al (2009) Hematopoietic Stem Cell Development Is Dependent on Blood Flow Cell 137(4):736–748 DOI: 10.1016/j.cell.2009.04.023
- Kalos, M et al (2011) T Cells with Chimeric Antigen Receptors Have Potent Antitumor Effects and Can Establish Memory in Patients with Advanced Leukemia Sci Transl Med 3, 95ra73 DOI: 10.1126/scitranslmed.3002842
- Porter DL et al. (2011) Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N. Engl. J. Med. 365:725-733 doi:10.1056/nejmoa1103849
- Sadelain M et al (2003) Targeting tumours with genetically enhanced T lymphocytes Nature Reviews Cancer 3, 35-45 doi:10.1038/nrc971
- Eshhar Z, Waks T, Gross G, Schindler DG (1993) Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc. Natl Acad. Sci. USA 90, 720–724
- Stancovski I et al. (1993) Targeting of T lymphocytes to Neu/HER2-expressing cells using chimeric single chain Fv receptors. J. Immunol. 151, 6577–6582
- Geiger TL, Jyothi MD (2001) Development and application of receptor-modified T lymphocytes for adoptive immunotherapy. Transfus. Med. Rev. 15, 21–34
- Ma Q, Gonzalo–Daganzo RM, Junghans R in Cancer Chemotherapy and Biological Response Modifiers, Annual 20 (eds Giaccone G, S. R. & Sondel P) 762 (Elsevier Science, New York, 2002)
- Brentjens R, Latouche JB, Riviere I, Sadelain M (2002) In vivo anti-tumor activity of genetically modified T cells is dependent on the method of ex vivo T cell expansion. Blood 100, 577a
- Porter DL et al (2011) Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N Engl J Med 365:725-733 DOI:10.1056/NEJMoa1103849
- Brentjens R et al (2013) CD19-Targeted T Cells Rapidly Induce Molecular Remissions in Adults with Chemotherapy-Refractory Acute Lymphoblastic Leukemia Sci Transl Med 5, 177ra38 DOI: 10.1126/scitranslmed.3005930
Last edited: 17 September 2014 15:58
