Leucemia
 La leucemia es una forma de cáncer de sangre causada por el crecimiento anómalo de las células sanguíneas. Habitualmente se asocia a la infancia, dado que es uno de los pocos cánceres que se diagnostican a esta edad, a pesar de que la leucemia es mucho más frecuente en personas de edad avanzada. Cada año alrededor de 350.000 personas reciben el diagnóstico de leucemia, con 250.000 muertesANCHOR.
La leucemia es una forma de cáncer de sangre causada por el crecimiento anómalo de las células sanguíneas. Habitualmente se asocia a la infancia, dado que es uno de los pocos cánceres que se diagnostican a esta edad, a pesar de que la leucemia es mucho más frecuente en personas de edad avanzada. Cada año alrededor de 350.000 personas reciben el diagnóstico de leucemia, con 250.000 muertesANCHOR.
La mayor parte de las leucemias son mieloides o linfocíticas /linfoblásticas, que afectan, respectivamente, a las células mieloides, que producen glóbulos rojos, y las células linfoides, que producen linfocitos (glóbulos blancos). Los dos tipos pueden ser agudas, en las que se produce un aumento rápido de linfocitos anómalos e inmaduros que desplazan a las células sanguíneas normales en la médula ósea, o crónicas, en las que la acumulación es más lenta y consiste mayoritariamente en células sanguíneas maduras. Las formas más frecuentes son la mieloide aguda y la linfocítica crónica. Cada una de ellas explica aproximadamente el 30% de los casos. Alrededor del 17% no encajan en esta clasificación.
A diferencia de la mayoría de cánceres, la leucemia surge a menudo de mutaciones genéticas relativamente simples y bien comprendidas. Esto ha permitido a los investigadores desarrollar tratamientos que han cambiado radicalmente el destino de los pacientes, a pesar de que éstos varían de modo significativo dependiendo del tipo de enfermedad.
Leucemia mieloide aguda
Leucemia mieloide crónica
Leucemia linfoblástica aguda
Leucemia linfocítica crónica
Referencias
Leucemia mieloide aguda
La tasa de supervivencia a cinco años para la leucemia mieloide aguda (LMA) en personas mayores de 65 años, la más frecuente geográficamente, representa menos del 10%. Es parecida a los cánceres sólidos, como el de mama o el de colon, en que cada célula alberga una combinación diferente de docenas de mutaciones. Esta diversidad es la que ha hecho que la LAM sea tan difícil de tratar respecto a otras leucemias.
El tratamiento estándar es la quimioterapia, aunque el transplante de células madre sanguíneas se encuentra potencialmente disponible para pacientes más sanos.
Actualmente los investigadores trabajan abordándo el cáncer de un modo muy distinto. Desde los años sesenta, los científicos han observado que existen patrones extraños de metilación de ADN en pacientes con leucemia. La metilación es el proceso en el que se adhiere un marcador químico, conocido como grupo metilo, al ADN. Este proceso ejerce un gran efecto y controla eficazmente si un gen se encuentra activo o inactivo. Esta es una forma de control conocida como epigenética.
En el 2004, se aprobó el primer fármaco de acción epigenética para prevenir la leucemia en pacientes con síndrome mielodisplásico, un cáncer no agresivo que progresa a LMA en un tercio de los casosANCHOR. La 5-azacitidina (Vidaza) y la decitabina (Dacogen) interfieren, ambos, en la metilación del ADN.
En un intento por hallar otras dianas para fármacos epigenéticos similares, los investigadores sometieron a cribado una librería de moléculas de ARN diseñadas para bloquear la actividad de las proteínas reguladoras epigenéticas en modelo murino de LMAANCHOR. Descubrieron que una proteína en particular, la Brd4, resultaba crítica en mantener las células cancerígenas. Para mostrar que ésta podría ser eficaz contra un amplío rango de subtipos de LMA, se usó un fármaco desarrollado previamente para bloquear la Brd4, el JQ1. La Brd4 funciona al 'leer' las marcas epigenéticas conocidas como grupo acetilo y proporciona información a otras proteínas que trabajan regulando el ADN.
En el 2008 se secuenció por primera vez el genoma de un paciente con LMA, con la esperanza de hallar tratamientos dirigidos en el futuro. Desde entonces, los desarrollos en la tecnología de la secuenciación han aumentado enormemente este potencial. En 2013, unos investigadores publicaron resultados de la secuenciación de ADN en 200 adultos con LMAANCHOR. Esto reveló que más de tres cuartos de los participantes poseían una mutación dañina en una enzima epigenética. Estas enzimas son las responsables de poner y quitar los marcadores químicos de las proteínas de ADN y las proteínas asociadas al ADN, a través de las cuales controlan la expresión y silenciamiento de los genes. Varias de estas enzimas, incluidas la DNMT3A, IDH1, IDH2, DOT1L y TET2, se han convertido en dianas para fármacos en proceso de desarrollo.
Leucemia mieloide crónica
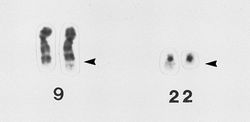 En 1960 unos científicos descubrieron que el 95% de los pacientes que padecen leucemia mieloide crónica (LMC) presentan una anomalía cromosómica en las células cancerosas. Desde entonces esta anomalía se conoce como cromosoma Filadelfia, por la ciudad en la que se descubrióANCHOR. Más tarde se reveló que esto era el resultado de partes de los cromosomas 9 y 22 que se intercambiaban el lugar, lo que fusiona dos genes conocidos como BCR y ABLANCHOR. No resultaba claro si esto lo causaba el cáncer o si, al contario, era en si una causa del cáncer hasta que los investigadores insertaron el gen fusionado BCR-ABL dentro de ratones y vieron que desencadenaba una enfermedad parecida a la LMCANCHOR ANCHOR ANCHOR ANCHOR. Como consecuencia, los trabajos se dirigieron a tratar de inhibir la actividad de este gen.
En 1960 unos científicos descubrieron que el 95% de los pacientes que padecen leucemia mieloide crónica (LMC) presentan una anomalía cromosómica en las células cancerosas. Desde entonces esta anomalía se conoce como cromosoma Filadelfia, por la ciudad en la que se descubrióANCHOR. Más tarde se reveló que esto era el resultado de partes de los cromosomas 9 y 22 que se intercambiaban el lugar, lo que fusiona dos genes conocidos como BCR y ABLANCHOR. No resultaba claro si esto lo causaba el cáncer o si, al contario, era en si una causa del cáncer hasta que los investigadores insertaron el gen fusionado BCR-ABL dentro de ratones y vieron que desencadenaba una enfermedad parecida a la LMCANCHOR ANCHOR ANCHOR ANCHOR. Como consecuencia, los trabajos se dirigieron a tratar de inhibir la actividad de este gen.
En 1996 se desarrolló un inhibidor, conocido después como imatinib, del gen BCR-ABL, a lo que siguieron pruebas exitosas en cultivos de células y ratonesANCHOR. Ensayos clínicos tempranos revelaron que se trataba de un fármaco excepcional, que causaba una remisión total en todos los pacientes. El imatinib fue aprobado en 2001 y vendido bajo el nombre comercial de Gleevec o Glivec. Esto representó un punto de inflexión en el tratamiento de la LMC y la esperanza de vida de los pacientes ha aumentado de 5-6 años a 10-20 con imatinib y fármacos de acción similar.
A pesar de que el imatinib resulta muy eficaz, la resistencia es a menudo un problema. Incluso en fases tempranas de la enfermedad, puede haber una gran inestabilidad genómica, lo que contribuye a la formación de nuevas mutaciones. Los estudios en ratones sugieren que es la proteína de BCR-ABL en si misma la que promueve esta inestabilidad ANCHOR. Después de ocho años, alrededor de la mitad de los pacientes pasaran a ser tratados con otro fármaco después de que el imatinib se haya hecho inefectivoANCHOR. Afortunadamente existen varias alternativas, incluidas el dasatinib, el nilotinib, bosutinib y pontinib (aprobado en diciembre de 2012), que pueden sortean varias mutaciones resistentes.
Leucemia linfoblástica aguda
La leucemia linfoblástica aguda (LLA) se diagnostica principalmente en niños y explica el 75% de los casos de leucemia en la infancia. En los años setenta mataba alrededor de dos tercios de los pacientes infantilesANCHOR, pero ya en 2005 se curaban el noventa por ciento de niños de menos de 15 años de edadANCHOR.
La aminopterina se introdujo en 1948 y se convirtió en el primer compuesto conocido capaz de inhibir el crecimiento del cáncerANCHOR. Conseguía la remisión temporal de LLA en niños. La Aminopterina es un antagonista del folato, que significa que bloquea las vías metabólicas que usan las vitaminas B9, o ácido fólico. Esto, en concreto, disminuye el crecimiento de la médula ósea, lo que permite la remisión de la leucemia.
Un año después de que se probara la aminopterina, se observó que un antagonista similar de folato llamado metotrexato producía una disminución del número de linfocitos en ratasANCHOR y prolongaba la supervivencia de ratones con leucemiaANCHOR. Más adelante éste compuesto reemplazó a la aminopterina como fármaco de elección, tras demostrarse en pruebas con ratones que tenía menos efectos secundarios que la aminopterinaANCHOR.
Alrededor del 20% de pacientes de LLA poseen el cromosoma de Filadelfia de modo que también puede tratarse con imatinib y fármacos similares.
Habitualmente se trata a los pacientes con quimioterapia para forzar la remisión del cáncer, lo que disminuye enormemente el número de células cancerosas en el cuerpo. No obstante, incluso unas pocas células restantes pueden hacer que el cáncer se reactive. Dosis elevadas de quimioterapia o irradiación corporal total ayudaran a destruir casi todas las células cancerosas, pero también puede aniquilar las células madre hematopoyéticas en la médula ósea que producen células sanguíneas. En este caso el tratamiento debe ir seguido de un trasplante de médula ósea de un donante para reemplazar las células perdidas.
Se usó un trasplante de médula ósea para curar la leucemia en 1985 por primera vez. Desde entonces la investigación ha permitido realizar trasplantes de médula ósea y células madre de donantes que no eran perfectamente compatibles con el receptor, lo cual ha aumentado enormemente la oportunidad de recibir este tratamiento.
El desarrollo de células madre hematopoyéticas depende del flujo sanguíneo tal como se observa en pruebas hechas en pez cebra. Los investigadores sometieron a prueba más de 2000 compuestos en pez cebra para comprobar sus efectos en el desarrollo de células madre y hallaron que los que afectaban al flujo sanguíneo aumentaban su producciónANCHOR. Los estudios más recientes mostraron efectos similares en ratones y pudieron ponerlo a prueba dejando fluir líquidos sobre las células madre en cultivos celulares. Se espera que estos fármacos puedan usarse para ayudar a la recuperación de pacientes que reciben trasplantes de células madre.
Leucemia linfocítica crónica
La leucemia linfocítica crónica (LCC) puede tratarse con quimioterapia y anticuerpos monoclonales. Presenta una tasa de supervivencia de cinco años de alrededor del 80%.
Algunos de los avances recientes más interesantes se han producido a través de la reprogramación de las células T de los pacientes para atacar y destruir el cáncer. Es posible modificar genéticamente una muestra de células T para producir un receptor quimérico de antígeno (CAR) que permite que se repliquen rápidamente en el cuerpo y alcancen a las células BANCHOR ANCHOR. Este receptor consiste en un anticuerpo, derivado de un anticuerpo monoclonal de ratón, diseñado para reconocer células BANCHOR. Esto destruye todas las células B del paciente, tanto sanas como cancerosas, lo cual tiene efectos graves pero al mismo tiempo resultados espectaculares en el tratamiento de cánceres resistentes a la quimioterapia. Actualmente este procedimiento se encuentra únicamente disponible en ensayos a pequeña escala, y una dificultad clave consistirá en ampliarlo para alcanzar a un mayor número de pacientes.
Esta tecnología se ha desarrollado a lo largo de varias décadas a partir de la modificación de células de hibridoma en ratónANCHOR ANCHOR para poder modificar las células T tomadas de un ratón o un pacienteANCHOR ANCHOR. La primera demostración de que las células T de un CAR encogían el cáncer se produjo en ratones en el año 2002ANCHOR. Desde entonces ha mostrado resultados positivos en ensayos clínicos para pacientes con LLCANCHOR, y desde entonces también se ha usado para tratar a pacientes con LLA recidivanteANCHOR.
Referencias
- Lozano R (2012) Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 Lancet 380(9859): 2095–128 doi:10.1016/S0140-6736(12)61728-0
- Kaminskas E, Farrell AT, Wang Y-C, Sridhara R, Pazdur R (2005) FDA Drug Approval Summary: Azacitidine (5-azacytidine, Vidaza) for Injectable Suspension The Oncologist 10(3):176–182 doi:10.1634/theoncologist.10-3-176
- Zuber J et al (2011) RNAi screen identifies Brd4 as a therapeutic target in acute myeloid leukaemia Nature 478, 524–528 doi: 10.1038/nature10334
- The Cancer Genome Atlas Research Network (2013) New England Journal of Medicine 368, 2059-2074
- Nowell P, Hungerford D (1960) A minute chromosome in chronic granulocytic leukemia Science 132(3438):1497 doi: 10.1126/science.132.3438.1488
- Rowley JD (1973) A New Consistent Chromosomal Abnormality in Chronic Myelogenous Leukaemia identified by Quinacrine Fluorescence and Giemsa Staining Nature 243, 290-293 doi:10.1038/243290a0
- Daley GQ, Van Etten RA, Baltimore D (1990) Induction of chronic myelogenous leukemia in mice by the P210 BCR-ABL gene of the Philadelphia chromosome Science 247, 824–830
- Elefanty AG, Hariharan IK, Cory S (1990) BCR-ABL, the hallmark of chronic myeloid leukaemia in man, induces multiple haemopoietic neoplasms in mice. EMBO J. 9, 1069–1078
- Heisterkamp N et al. (1990) Acute leukaemia in bcr/abl transgenic mice Nature 344:251-253
- Kelliher MA et al (1990) Induction of a chronic myelogenous leukaemia-like syndrome in mice with v-abl and BCR-ABL Proc Natl Acad Sci USA 87, 6649-6653
- Druker BJ et al. (1996) Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells Nature Medicine 2, 561–566 doi:10.1038/nm0596-561
- Salloukh HF, Laneuville P (2000) Increase in mutant frequencies in mice expressing the BCR-ABL activated tyrosine kinase. Leukemia 14, 1401–1404
- Marin D et al (2012) Assessment of BCR-ABL1 Transcript Levels at 3 Months Is the Only Requirement for Predicting Outcome for Patients With Chronic Myeloid Leukemia Treated With Tyrosine Kinase Inhibitors J Clin Oncol 30, 232-238 DOI: 10.1200/JCO.2011.38.6565
- Steliarova-Foucher E, Stiller C, Kaatsch P et al (2004) Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCIS project): an epidemiological study Lancet 364:2097–2105
- Hunger SP et al (2012) Improved Survival for Children and Adolescents With Acute Lymphoblastic Leukemia Between 1990 and 2005: A Report From the Children's Oncology Group. Journal of Clinical Oncology
- Farber S, Diamond LK (1948) Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4-aminopteroyl-glutamic acid. N Engl J Med. 238(23):787-93
- Franklin A, Belt M, Stoksstad E & Jukes T (1949) J Biol Chem 177, 621-629
- Burchenal J, Johnson S, Burchenal JR, Kushida M, Robinson E & Stock C (1949) Proc Soc Exper Biol Med 71, 381- 387
- Goldin A, Venditti JM, Humphreys SR, Dennis D, Mantel N, Greenhouse SW (1955) A quantitative comparison of the antileukemic effectiveness of two folic acid antagonists in mice J. Natl. Cancer Inst. 15 (6): 1657–64.
- North TE et al (2009) Hematopoietic Stem Cell Development Is Dependent on Blood Flow Cell 137(4):736–748 DOI: 10.1016/j.cell.2009.04.023
- Kalos, M et al (2011) T Cells with Chimeric Antigen Receptors Have Potent Antitumor Effects and Can Establish Memory in Patients with Advanced Leukemia Sci Transl Med 3, 95ra73 DOI: 10.1126/scitranslmed.3002842
- Porter DL et al. (2011) Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N. Engl. J. Med. 365:725-733 doi:10.1056/nejmoa1103849
- Sadelain M et al (2003) Targeting tumours with genetically enhanced T lymphocytes Nature Reviews Cancer 3, 35-45 doi:10.1038/nrc971
- Eshhar Z, Waks T, Gross G, Schindler DG (1993) Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc. Natl Acad. Sci. USA 90, 720–724
- Stancovski I et al. (1993) Targeting of T lymphocytes to Neu/HER2-expressing cells using chimeric single chain Fv receptors. J. Immunol. 151, 6577–6582
- Geiger TL, Jyothi MD (2001) Development and application of receptor-modified T lymphocytes for adoptive immunotherapy. Transfus. Med. Rev. 15, 21–34
- Ma Q, Gonzalo–Daganzo RM, Junghans R in Cancer Chemotherapy and Biological Response Modifiers, Annual 20 (eds Giaccone G, S. R. & Sondel P) 762 (Elsevier Science, New York, 2002)
- Brentjens R, Latouche JB, Riviere I, Sadelain M (2002) In vivo anti-tumor activity of genetically modified T cells is dependent on the method of ex vivo T cell expansion. Blood 100, 577a
- Porter DL et al (2011) Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N Engl J Med 365:725-733 DOI:10.1056/NEJMoa1103849
- Brentjens R et al (2013) CD19-Targeted T Cells Rapidly Induce Molecular Remissions in Adults with Chemotherapy-Refractory Acute Lymphoblastic Leukemia Sci Transl Med 5, 177ra38 DOI: 10.1126/scitranslmed.3005930
Last edited: 17 September 2014 16:16
