Lymphome
« Lymphome » est un terme fourre-tout qui recouvre jusqu'à 40 sortes de cancer impliquant des globules blancs appelés lymphocytes. Les lymphomes sont généralement divisés en deux types, les lymphomes hodgkinien et non hodgkinien, ce dernier comptant pour environ 80 % des cas.1
>Pathologie
>Greffes de cellules souches
>Anticorps
>Vaccins
>Références
Pathologie
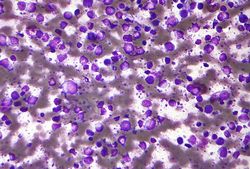
Les lymphomes hodgkinien et non hodgkinien sont tous deux provoqués par des globules blancs cancéreux présents dans les ganglions lymphatiques, mais les catégories de globules blancs affectés ne sont pas les mêmes. Et d'ailleurs, la seule manière de différencier les deux types de lymphome est d'observer les cellules des ganglions lymphatiques sous un microscope. Le lymphome hodgkinien est caractérisé par la présence de cellules de Reed-Sternberg.
Il touche généralement les jeunes adultes (15-40 ans) et les plus de 55 ans.2 Bien que le lymphome non hodgkinien soit principalement observé chez les adultes de plus de 65 ans, il représente un des cancers les plus répandus chez les enfants3.
Les taux de survie varient considérablement en fonction du type et du stade de la maladie, ainsi que de l'âge du patient, mais les taux ont augmenté de façon spectaculaire au cours des trois dernières décennies.2,3 Les traitements standard sont la radiothérapie ou la chimiothérapie mais de nouvelles découvertes ont vu le jour ces dernières années.
Greffes de cellules souches
La chimiothérapie et la radiothérapie sont souvent utilisées pour détruire les globules blancs cancéreux ; toutefois, ces thérapies tuent également les cellules immunitaires fonctionnelles, ainsi que les cellules souches qui peuvent en produire davantage. Pour résoudre ce problème après le traitement, les patients peuvent recevoir une greffe de cellules souches hématopoïétiques, localisées dans la moelle osseuse.
Jusque dans les années 1970, les greffes de moelle osseuse étaient jugées irréalisables.4 Toutes les tentatives avaient entraîné la mort, par infections ou réactions immunitaires. C'était assez inattendu après des essais probants chez les rongeurs ; mais cela peut s'expliquer par la consanguinité qui caractérise les souches de laboratoire.
Don Thomas, lauréat du prix Nobel pour ses travaux en 1990, a mené ses recherches sur des chiens qui ont des variations génétiques similaires à celles des humains et qui peuvent développer des maladies du sang comme le lymphome non hodgkinien.4 Il a mis au point une procédure comprenant l'irradiation, pour détruire le cancer, la correspondance des tissus entre donneurs et bénéficiaires et des cocktails de médicaments pour réprimer le système immunitaire. Après des taux de survie initialement faibles, l'amélioration progressive des médicaments antirejet a permis de réaliser, en 1979, des greffes à partir de donneurs non apparentés.
Récemment, il a été montré que le meloxicam, un médicament similaire à l'aspirine, incitait les cellules souches à quitter la moelle osseuse suite à une greffe, ce qui peut poser problème en particulier pour le lymphome non hodgkinien.5 Après avoir été étudié sur des souris et des babouins, des essais sur les humains sont maintenant en cours.
Anticorps
Pour éviter de détruire les cellules souches hématopoïétiques, les anticorps monoclonaux peuvent être utilisés pour cibler spécifiquement les lymphocytes, y compris les cellules malignes qui causent le lymphome. Les anticorps reconnaissent ces cellules et s'y fixent, ce qui active d'autres éléments du système immunitaire pour mieux détruire les cellules. Campath 1-H, ou l'alemtuzumab, est un anticorps de rat humanisé qui a d'abord été utilisé avec succès en 1988 pour traiter le lymphome non hodgkinien.6,7 L'anticorps de rat d'origine avait été rejeté par le système immunitaire et détruit. Mais grâce aux techniques de génie génétique, les chercheurs ont réussi à prélever les régions de reconnaissance essentielles de l'anticorps murin et les ont placées dans le gène de l'anticorps humain. Cette approche révolutionnaire a depuis été appliquée à d'autres cancers. L'anticorps campath est maintenant en cours d'étude pour savoir s'il peut jouer un rôle dans le traitement de la sclérose en plaques.8,9
Le rituxan, ou rituximab, l'un des traitements standard du lymphome, repose sur le même principe que Campath.10 C'est un anticorps chimérique murin/humain souvent utilisé en combinaison avec une chimiothérapie connue sous le nom de CHOP (cyclophosphamide, hydroxydaunorubicine, oncovin, prednisone). Il est également utilisé dans le traitement de la leucémie lymphoblastique chronique et de la polyarthrite rhumatoïde.11
Les anticorps ont également été utilisés pour diriger les sources de rayonnement sur les cellules cancéreuses et ainsi pour les cibler plus efficacement.12 Zevalin (ibritumonab tiuxetan) et Bexxar (tositumomab) ont été des médicaments pionniers approuvés au début des années 2000.13 Ils sont formés à partir d'isotopes radioactifs fixés aux anticorps de souris ; ils reconnaissent les cellules cancéreuses et se lient à elles. Ce sont des traitements très puissants, efficaces contre les cancers résistants au rituxan.
Vaccins
Contrairement à la plupart des vaccins qui visent à prévenir une maladie, le vaccin antilymphome stimule l'attaque par le système immunitaire des cellules cancéreuses déjà présentes.14 Les premiers vaccins, peu efficaces, ont échoué aux essais cliniques. Mais en 2010, un nouveau vaccin appelé BiovaxID a donné des résultats prometteurs lors des essais cliniques de phase III.15 Il cible une certaine protéine à la surface des cellules cancéreuses, connue sous le nom d'idiotype. Actuellement, chaque vaccin doit être fait sur mesure pour chaque cancer de patient. Cela peut prendre plusieurs mois et c'est très cher. Les études se poursuivent donc pour trouver une cible générique pour tous les lymphomes.
Le vaccin cible actuellement le lymphome folliculaire, la forme la plus courante de lymphome de faible grade. Le cancer tend à évoluer selon des cycles de rémission et de rechute tout en développant une résistance aux différents traitements. Le vaccin est conçu pour être utilisé dans les premiers stades ou lorsque le cancer est en rémission afin de cibler les cellules restantes. Cette approche augmente le délai entre les rechutes, qui passe de 30 mois à 44 mois.
En 2012, la FDA a déclaré qu'elle n'approuverait pas le vaccin aux États-Unis sans des essais supplémentaires, ce qui a entraîné la faillite du fabricant.16 Cependant, on s'attend à une autorisation de mise sur le marché du vaccin en Europe et au Canada à la fin 2014.
Références
- http://www.canceractive.com/cancer-active-page-link.aspx?n=164
- http://www.cancerresearchuk.org/cancer-info/cancerstats/types/hodgkinslymphoma/
- http://www.cancerresearchuk.org/cancer-info/cancerstats/types/nhl/
- http://www.cancerresearchuk.org/cancer-info/cancerstats/types/nhl/
- http://www.cancerresearchuk.org/cancer-info/cancerstats/types/hodgkinslymphoma/
- http://www.nature.com/nature/journal/v491/n7424/full/491334a.html
- http://www.nature.com/nature/journal/v491/n7424/full/491334a.html
- Hoggatt J et al (2013) Differential stem- and progenitor-cell trafficking by prostaglandin E2 Nature 495:365–369 doi:10.1038/nature11929
- http://www.newscientist.com/article/mg13318103.700-technology-human-antibody-goes-on-trial.html
- Riechmann L, Clark M, Waldmann H, Winter G. (1988) Reshaping human antibodies for therapy. Nature 332:323-7 doi:10.1038/332323a0
- Cohen JA et al (2012) Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial The Lancet 380(9856):1819-1828 doi:10.1016/S0140-6736(12)61769-3
- Coles AJ et al (2012) Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial The Lancet 380(9856):1829-1839 doi:10.1016/S0140-6736(12)61768-1
- Scott SD (1998) Rituximab: a new therapeutic monoclonal antibody for non-Hodgkin's lymphoma Cancer Pract 6(3): 195–7. doi:10.1046/j.1523-5394.1998.006003195.x
- Saini KS et al (2011) Rituximab in Hodgkin lymphoma: Is the target always a hit? Cancer Treat Rev 37 (5): 385–90 doi:10.1016/j.ctrv.2010.11.005
- Milenic DE, Brady ED and Brechbiel MW (2004) Antibody-targeted radiation cancer therapy Nature Rev Drug Discovery 3:488-98 doi:10.1038/nrd1413
- Rao AV, Akabani G and Rizzieri DA (2005) Radioimmunotherapy for Non-Hodgkin's Lymphoma Clin Med Res 3(3):157-65 doi:10.3121/cmr.3.3.157
- Lee ST et al (2007) BiovaxID: a personalized therapeutic cancer vaccine for non-Hodgkin's lymphoma Expert Opin Biol Ther 7(1):113-22 doi:10.1517/14712598.7.1.113
- Schuster SJ et al (2011) Vaccination With Patient-Specific Tumor-Derived Antigen in First Remission Improves Disease-Free Survival in Follicular Lymphoma Journal of Clinical Oncology 29 doi: 10.1200/JCO.2010.33.3005
- http://www.fiercevaccines.com/story/biovest-bankruptcy-shows-travails-cancer-vaccine-development/2013-03-13
Last edited: 15 October 2014 12:18
