Leucemia
 La leucemia è una forma di tumore del sangue causata dalla crescita anomala di cellule del sangue. È normalmente associata ai bambini, perché è uno dei pochi tipi di tumore che colpisce anche in età infantile, anche se la malattia è molto più comune tra gli adulti. Circa 350.000 persone ricevono una diagnosi di leucemia ogni anno, e si contano 250.000 mortiANCHOR.
La leucemia è una forma di tumore del sangue causata dalla crescita anomala di cellule del sangue. È normalmente associata ai bambini, perché è uno dei pochi tipi di tumore che colpisce anche in età infantile, anche se la malattia è molto più comune tra gli adulti. Circa 350.000 persone ricevono una diagnosi di leucemia ogni anno, e si contano 250.000 mortiANCHOR.
La maggior parte delle leucemie sono mieloidi o linfocitiche/linfoblastiche: queste forme colpiscono rispettivamente le cellule mieloidi, che producono i globuli rossi, e le cellule linfoidi, che producono linfociti. Entrambi i tipi di leucemie possono essere acute, quando un rapido aumento di linfociti anormali immaturi soppianta le cellule normali nel midollo osseo, o croniche, quando questa sostituzione è più lenta e riguarda soprattutto cellule del sangue mature. Le forme più comuni sono la leucemia acuta mieloide e la leucemia cronica linfocitica: queste due tipologie costituiscono ciascuna circa il 30% dei casi. Circa il 17% dei casi sono rappresentati da altri tipi di leucemia.
A differenza della maggior parte dei tumori, la leucemia spesso si sviluppa a causa di mutazioni genetiche piuttosto semplici e ben conosciute. Questo ha permesso ai ricercatori di sviluppare trattamenti che hanno cambiato in modo drastico il destino dei pazienti, sebbene questo dipenda molto dal tipo di leucemia.
Leucemia acuta mieloide
Leucemia cronica mieloide
Leucemia linfoblastica acuta
Leucemia linfocitica cronica
Bibliografia
Leucemia acuta mieloide
Per le persone sopra i 65 anni che soffrono di leucemia acuta mieloide (LAM), il gruppo più colpito dalla malattia, la sopravvivenza a cinque anni è meno del 10%. Come per i tumori solidi, come il tumore al seno o al colon, anche per questo tipo di cancro ogni persona e persino ogni singola cellula ospita una diversa combinazione di decine di mutazioni. È per questa diversità che la LAM è difficile da trattare rispetto ad altri tipi di leucemia.
Il trattamento comune è la chemioterapia, con trapianti di cellule staminali del sangue potenzialmente disponibili per i pazienti più sani.
Alcuni ricercatori stanno ora lavorando a un approccio molto diverso per colpire questo tipo di cancro. Dagli anni Sessanta del secolo scorso alcuni scienziati hanno notato che la metilazione del DNA nei pazienti colpiti da leucemia presentava alcune anomalie. La metilazione è un processo che consiste nell’aggiungere “etichette” chimiche, chiamate gruppi metile, al DNA. Questo fenomeno può avere effetti non trascurabili, e può controllare il fatto che un gene sia attivato o disattivato. È una forma di controllo chiamata epigenetica.
Nel 2004, il primo farmaco in grado di agire a livello epigenetico è stato approvato per prevenire la leucemia nei pazienti affetti da sindrome mielodisplastica, un tumore non aggressivo che può trasformarsi in LAM in un terzo dei casiANCHOR. I farmaci 5-azacitidina (Vidaza) e decitabina (Dacogen) possono interferire con la metilazione del DNA.
Cercando altri possibili obiettivi per simili farmaci epigenetici, alcuni ricercatori hanno passato in rassegna una libreria di molecole di RNA costruite per bloccare l’attività di proteine coinvolte nel controllo epigenetico in un modello di topo della LAMANCHOR. Una particolare proteina, hanno scoperto, era fondamentale per mantenere in vita le cellule tumorali: Brd4. Un farmaco sviluppato in precedenza per bloccare questa proteina, JQ1, è stato usato per mostrare che poteva essere efficace contro alcuni sottotipi di LAM. La proteina Brd4 agisce leggendo i segnali epigenetici chiamati gruppi acetile e fornendo informazioni ad altre proteine che regolano il DNA.
Il genoma di un paziente affetto da LAM è stato sequenziato per la prima volta nel 2008, facendo crescere le speranze per future terapie personalizzate. Da allora, gli sviluppi nelle tecniche di sequenziamento hanno aumentato molto questa possibilità. Nel 2013, alcuni ricercatori hanno pubblicato i risultati del sequenziamento del DNA di 200 adulti colpiti da LAMANCHOR. I risultati hanno evidenziato che più di tre quarti dei pazienti avevano mutazioni dannose in un enzima coinvolto nel controllo epigenetico. Questi enzimi sono responsabili dell’applicazione e della rimozione di “etichette” chimiche dal DNA e da proteine associate al DNA: con questa attività gli enzimi controllano l’espressione e il silenziamento dei geni. Molti di questi enzimi, tra cui DNMT3A, IDH1, IDH2, DOT1L e TET2, sono ora obiettivi di farmaci in via di sviluppo.
La leucemia cronica mieloide
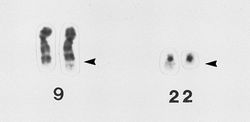 Nel 1960, alcuni ricercatori hanno scoperto che il 95% dei pazienti con leucemia cronica mieloide (LCM) presentava anomalie cromosomiche nelle cellule tumorali: si tratta del cosiddetto cromosoma Philadelphia, così chiamato dalla città nella quale è stato scopertoANCHOR. Più tardi si è capito che questa anomalia derivava dallo spostamento di alcune porzioni dei cromosomi 9 e 22: a causa di questo scambio si arriva a una fusione dei geni BCR e ABLANCHOR. Non era chiaro se questa anomalia fosse una delle cause del tumore o se una delle sue conseguenze: per comprenderlo alcuni ricercatori hanno inserito il gene fuso BCR-ABL in un gruppo di topi, osservando che il gene causava una patologia simile alla LCMANCHOR ANCHOR ANCHOR ANCHOR. Questi risultati hanno spinto i ricercatori a cercare di inibire l’attività del gene BCR-ABL. Un inibitore di questo gene, chiamato in seguito imatinib, è stato sviluppato nel 1996 dopo il successo di esperimenti su colture cellulari e topiANCHOR. I primi studi clinici hanno mostrato che il farmaco può funzionare, portando alla remissione completa della malattia in tutti i pazienti. L’imatinib è stato approvato nel 2001, ed è stato venduto con il nome commercial Gleevec o Glivec. Questo è stato un punto di svolta per il trattamento della LCM, e l’aspettativa di vita per i pazienti è salita da 5-6 anni a 10-20 anni grazie a simili farmaci.
Nel 1960, alcuni ricercatori hanno scoperto che il 95% dei pazienti con leucemia cronica mieloide (LCM) presentava anomalie cromosomiche nelle cellule tumorali: si tratta del cosiddetto cromosoma Philadelphia, così chiamato dalla città nella quale è stato scopertoANCHOR. Più tardi si è capito che questa anomalia derivava dallo spostamento di alcune porzioni dei cromosomi 9 e 22: a causa di questo scambio si arriva a una fusione dei geni BCR e ABLANCHOR. Non era chiaro se questa anomalia fosse una delle cause del tumore o se una delle sue conseguenze: per comprenderlo alcuni ricercatori hanno inserito il gene fuso BCR-ABL in un gruppo di topi, osservando che il gene causava una patologia simile alla LCMANCHOR ANCHOR ANCHOR ANCHOR. Questi risultati hanno spinto i ricercatori a cercare di inibire l’attività del gene BCR-ABL. Un inibitore di questo gene, chiamato in seguito imatinib, è stato sviluppato nel 1996 dopo il successo di esperimenti su colture cellulari e topiANCHOR. I primi studi clinici hanno mostrato che il farmaco può funzionare, portando alla remissione completa della malattia in tutti i pazienti. L’imatinib è stato approvato nel 2001, ed è stato venduto con il nome commercial Gleevec o Glivec. Questo è stato un punto di svolta per il trattamento della LCM, e l’aspettativa di vita per i pazienti è salita da 5-6 anni a 10-20 anni grazie a simili farmaci.
Sebbene l’imatinib sia molto efficace, la resistenza al farmaco è spesso un problema. Anche nelle prime fasi della malattia ci può essere molta instabilità genomica, che favorisce la formazione di nuove mutazioni. Studi condotti nei topi suggeriscono che la proteina BCR-ABL sia a sua volta in grado di indurre questa instabilitàANCHOR. Dopo otto anni, circa la metà dei pazienti trattati con l’imatinib sono stati indirizzati verso un altro farmaco, quando il trattamento è diventato inefficaceANCHOR. Per fortuna ci sono diverse alternative, tra cui il dasatinib, il nilotinib, il bosutinib e il pontinib (approvato nel dicembre 2012), per intervenire in caso di mutazioni che inducono resistenza.
Leucemia acuta linfoblastica
La leucemia acuta linfoblastica (LAL) colpisce soprattutto i bambini e rappresenta il 75% di tutti i casi di leucemia infantile. Negli anni Settanta del secolo scorso questa malattia uccideva circa i due terzi dei bambini colpitiANCHOR, ma secondo i dati del 2005 il 90% dei bambini sotto i 15 anni possono essere curatiANCHOR.
L’aminopterina è stata introdotta nel 1948, il primo prodotto conosciuto in grado di inibire la crescita tumoraleANCHOR. Grazie al farmaco i bambini affetti dalla LAL sono entrati in remissione temporanea. L’aminopterina è un antifolato, cioè una sostanza che blocca le vie metaboliche che utilizzano la vitamina B9, o acido folico. Questo processo in particolare rallenta la crescita del midollo osseo e così facendo la leucemia va in remissione. Un anno dopo l’introduzione dell’aminopterina, un simile antifolato, chiamato metotrexato, si è dimostrato capace di ridurre i leucociti nei rattiANCHOR e di aumentare la sopravvivenza dei topi colpiti da leucemiaANCHOR. Questa sostanza in seguito ha sostituito l’aminopterina come farmaco di prima scelta, dopo che alcuni esperimenti hanno mostrato che nei topi aveva meno effetti collaterali dell’aminopterinaANCHOR.
Circa il 20% dei pazienti colpiti da LAL hanno il cromosoma Philadelphia, e possono quindi essere trattati con l’imatinib e simili farmaci.
I pazienti in genere sono sottoposti a chemioterapia per ottenere la remissione del cancro, trattamento che riduce in modo sostanziale il numero di cellule tumorali nel corpo. Tuttavia, anche le poche cellule rimaste possono portare a un ritorno del cancro. Alte dosi di chemioterapia o radiazioni possono aiutare a distruggere quasi tutte le cellule tumorali, ma possono anche danneggiare le cellule staminali ematopoietiche nel midollo osseo, che producono le cellule del sangue. Questo processo deve essere seguito da un trapianto di cellule staminali o di midollo osseo da parte di un donatore, per sostituire le cellule perse.
I trapianti di midollo osseo per curare la leucemia sono stati utilizzati per la prima volta nel 1985. Da allora, la ricerca ha permesso il trapianto di midollo osseo e di cellule staminali anche da donatori che non sono perfettamente compatibili con il ricevente; questo ha aumentato molto le opportunità di applicare questa terapia.
Lo sviluppo di cellule staminali ematopoietiche dipende dal flusso sanguigno, come dimostrano alcuni esperimenti condotti sugli zebrafish. Alcuni ricercatori hanno testato più di 2000 farmaci su questo modello animale per verificare gli effetti sullo sviluppo di cellule staminali: i farmaci che influenzavano il flusso sanguigno, hanno osservato, aumentavano la produzione di cellule staminaliANCHOR. Successive ricerche hanno mostrato effetti simili sui topi, e facendo scorrere liquidi su cellule staminali in coltura si è potuto verificare l’effetto in vitro. La speranza è che questi farmaci possano essere usati per aiutare il recupero nei pazienti che ricevono trapianti di cellule staminali.
Leucemia cronica linfocitica
La leucemia cronica linfocitica (LCL) può essere trattata con chemioterapia e anticorpi monoclonali. Ha un tasso di sopravvivenza a cinque anni dalla diagnosi di circa l’80%. Alcuni dei più eccitanti sviluppi recenti sono stati ottenuti grazie alla riprogrammazione delle cellule T dei pazienti, indotte ad attaccare e uccidere le cellule tumorali. Un campione di cellule T può essere modificato geneticamente per produrre un recettore chimerico specifico per un antigene: questo permette alle cellule di duplicarsi rapidamente nel corpo e raggiungere le cellule BANCHOR ANCHOR. Questo recettore è composto da un anticorpo, che proviene da un anticorpo monoclonale di topo, che riconosce le cellule BANCHOR. In questo modo le cellule B del paziente possono essere distrutte: si colpiscono però sia le cellule sane che quelle tumorali, una procedura che può avere gravi effetti collaterali ma anche un grande successo nel trattare tumori che non sono stati eliminati dalla chemioterapia. Oggi questa terapia è disponibile solo in piccoli studi clinici, e una difficoltà primaria sarà quella di allargare la sperimentazione a più pazienti.
Questa tecnologia è stata sviluppata nel corso di diversi decenni: dalla modificazione di cellule ibride nel topoANCHOR ANCHOR a quella di cellule T di topi o pazientiANCHOR ANCHOR. Nel 2002 è stato dimostrato per la volta che una cellula T dotata di recettore chimerico specifico per un antigene può ridurre il cancro nei topiANCHOR. Da allora la tecnica è stata usata con successo in alcuni studi clinici per pazienti affetti da leucemia cronica linfociticaANCHOR, ed è stata anche impiegata per trattare pazienti colpiti da leucemia acuta linfocitica che avevano subito una ricadutaANCHOR.
References
- Lozano R (2012) Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010 Lancet 380(9859): 2095–128 doi:10.1016/S0140-6736(12)61728-0
- Kaminskas E, Farrell AT, Wang Y-C, Sridhara R, Pazdur R (2005) FDA Drug Approval Summary: Azacitidine (5-azacytidine, Vidaza) for Injectable Suspension The Oncologist 10(3):176–182 doi:10.1634/theoncologist.10-3-176
- Zuber J et al (2011) RNAi screen identifies Brd4 as a therapeutic target in acute myeloid leukaemia Nature 478, 524–528 doi: 10.1038/nature10334
- The Cancer Genome Atlas Research Network (2013) New England Journal of Medicine 368, 2059-2074
- Nowell P, Hungerford D (1960) A minute chromosome in chronic granulocytic leukemia Science 132(3438):1497 doi: 10.1126/science.132.3438.1488
- Rowley JD (1973) A New Consistent Chromosomal Abnormality in Chronic Myelogenous Leukaemia identified by Quinacrine Fluorescence and Giemsa Staining Nature 243, 290-293 doi:10.1038/243290a0
- Daley GQ, Van Etten RA, Baltimore D (1990) Induction of chronic myelogenous leukemia in mice by the P210 BCR-ABL gene of the Philadelphia chromosome Science 247, 824–830
- Elefanty AG, Hariharan IK, Cory S (1990) BCR-ABL, the hallmark of chronic myeloid leukaemia in man, induces multiple haemopoietic neoplasms in mice. EMBO J. 9, 1069–1078
- Heisterkamp N et al. (1990) Acute leukaemia in bcr/abl transgenic mice Nature 344:251-253
- Kelliher MA et al (1990) Induction of a chronic myelogenous leukaemia-like syndrome in mice with v-abl and BCR-ABL Proc Natl Acad Sci USA 87, 6649-6653
- Druker BJ et al. (1996) Effects of a selective inhibitor of the Abl tyrosine kinase on the growth of Bcr-Abl positive cells Nature Medicine 2, 561–566 doi:10.1038/nm0596-561
- Salloukh HF, Laneuville P (2000) Increase in mutant frequencies in mice expressing the BCR-ABL activated tyrosine kinase. Leukemia 14, 1401–1404
- Marin D et al (2012) Assessment of BCR-ABL1 Transcript Levels at 3 Months Is the Only Requirement for Predicting Outcome for Patients With Chronic Myeloid Leukemia Treated With Tyrosine Kinase Inhibitors J Clin Oncol 30, 232-238 DOI: 10.1200/JCO.2011.38.6565
- Steliarova-Foucher E, Stiller C, Kaatsch P et al (2004) Geographical patterns and time trends of cancer incidence and survival among children and adolescents in Europe since the 1970s (the ACCIS project): an epidemiological study Lancet 364:2097–2105
- Hunger SP et al (2012) Improved Survival for Children and Adolescents With Acute Lymphoblastic Leukemia Between 1990 and 2005: A Report From the Children's Oncology Group. Journal of Clinical Oncology
- Farber S, Diamond LK (1948) Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4-aminopteroyl-glutamic acid. N Engl J Med. 238(23):787-93
- Franklin A, Belt M, Stoksstad E & Jukes T (1949) J Biol Chem 177, 621-629
- Burchenal J, Johnson S, Burchenal JR, Kushida M, Robinson E & Stock C (1949) Proc Soc Exper Biol Med 71, 381- 387
- Goldin A, Venditti JM, Humphreys SR, Dennis D, Mantel N, Greenhouse SW (1955) A quantitative comparison of the antileukemic effectiveness of two folic acid antagonists in mice J. Natl. Cancer Inst. 15 (6): 1657–64.
- North TE et al (2009) Hematopoietic Stem Cell Development Is Dependent on Blood Flow Cell 137(4):736–748 DOI: 10.1016/j.cell.2009.04.023
- Kalos, M et al (2011) T Cells with Chimeric Antigen Receptors Have Potent Antitumor Effects and Can Establish Memory in Patients with Advanced Leukemia Sci Transl Med 3, 95ra73 DOI: 10.1126/scitranslmed.3002842
- Porter DL et al. (2011) Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N. Engl. J. Med. 365:725-733 doi:10.1056/nejmoa1103849
- Sadelain M et al (2003) Targeting tumours with genetically enhanced T lymphocytes Nature Reviews Cancer 3, 35-45 doi:10.1038/nrc971
- Eshhar Z, Waks T, Gross G, Schindler DG (1993) Specific activation and targeting of cytotoxic lymphocytes through chimeric single chains consisting of antibody-binding domains and the gamma or zeta subunits of the immunoglobulin and T-cell receptors. Proc. Natl Acad. Sci. USA 90, 720–724
- Stancovski I et al. (1993) Targeting of T lymphocytes to Neu/HER2-expressing cells using chimeric single chain Fv receptors. J. Immunol. 151, 6577–6582
- Geiger TL, Jyothi MD (2001) Development and application of receptor-modified T lymphocytes for adoptive immunotherapy. Transfus. Med. Rev. 15, 21–34
- Ma Q, Gonzalo–Daganzo RM, Junghans R in Cancer Chemotherapy and Biological Response Modifiers, Annual 20 (eds Giaccone G, S. R. & Sondel P) 762 (Elsevier Science, New York, 2002)
- Brentjens R, Latouche JB, Riviere I, Sadelain M (2002) In vivo anti-tumor activity of genetically modified T cells is dependent on the method of ex vivo T cell expansion. Blood 100, 577a
- Porter DL et al (2011) Chimeric Antigen Receptor–Modified T Cells in Chronic Lymphoid Leukemia N Engl J Med 365:725-733 DOI:10.1056/NEJMoa1103849
- Brentjens R et al (2013) CD19-Targeted T Cells Rapidly Induce Molecular Remissions in Adults with Chemotherapy-Refractory Acute Lymphoblastic Leukemia Sci Transl Med 5, 177ra38 DOI: 10.1126/scitranslmed.3005930
Last edited: 17 September 2014 16:00
