Le SIDA et le VIH
 Au début de l'année 1981, les médecins des hôpitaux de New York et de San Francisco ont commencé à voir des patients avec des symptômes étranges. De jeunes hommes montraient des signes de maladies rares, inhabituels pour leur âge. En juillet 1981, le New York Times a annoncé l'apparition d'une forme rare de cancer, spécifiquement parmi les hommes homosexuels, appelé Sarcome de KaposiANCHOR. Au cours des mois et des années suivantes, les médecins ont constaté une augmentation du nombre d'hommes homosexuels rencontrant de graves difficultés à lutter contre un certain nombre d'infections courantes et de cancers.
Au début de l'année 1981, les médecins des hôpitaux de New York et de San Francisco ont commencé à voir des patients avec des symptômes étranges. De jeunes hommes montraient des signes de maladies rares, inhabituels pour leur âge. En juillet 1981, le New York Times a annoncé l'apparition d'une forme rare de cancer, spécifiquement parmi les hommes homosexuels, appelé Sarcome de KaposiANCHOR. Au cours des mois et des années suivantes, les médecins ont constaté une augmentation du nombre d'hommes homosexuels rencontrant de graves difficultés à lutter contre un certain nombre d'infections courantes et de cancers.
Les médecins ont bientôt découvert un point commun entre tous ces hommes : les cellules CD4+, essentielles pour maintenir un système immunitaire sain, leur faisaient défaut. Un an plus tard, les Centres pour le contrôle et la prévention des maladies avaient suffisamment de preuves pour établir un lien entre la maladie et le sang ; ils ont nommé la maladie le SIDA (syndrome d'immunodéficience acquise)ANCHOR. Au cours des années qui ont suivi, il était devenu évident que la cause du SIDA était contagieuse, mais c'est seulement en 1984 qu'un virus nommé VIH (virus de l'immunodéficience humaine) a été reconnu comme étant responsable du SIDA.
Pour en savoir plus sur cette histoire du VIH et du SIDA, consultez les pages d'histoire sur le site internet AVERT, qui comprend un calendrier mettant en lumière certains des développements les plus importants.
Qu'est-ce que le VIH ?
Test de dépistage du VIH
Modèles animaux du VIH
Développement et utilisation de médicaments antirétroviraux
La recherche d'un vaccin
Approches de développement d'un vaccin
Les essais STEP et Phambili sur le vaccin MRK-Ad5
La marche à suivre
Références
Qu'est-ce que le VIH ?
Le rétrovirus de l'immunodéficience humaine, VIH, est un virus à ARN. Lorsque le VIH infecte les cellules du corps, son ARN viral est reconnu par les cellules qui produisent alors les brins d'ADN complémentaires. Progressivement, cet ADN du VIH s'intègre dans l'ADN de la cellule-hôte pour devenir un provirus. Dès cette étape accomplie, chaque fois que la cellule se réplique, l'ADN du VIH est également répliqué. La cellule peut rester à l'état dormant pendant un long moment, mais quand elle est activée, elle produit de nouvelles particules virales qui vont infecter d'autres cellules.
Cette réaction en chaîne conduit l'organisme à initier une réponse immunitaire, avec notamment la production d'anticorps dirigés spécifiquement contre le VIH. Alors que le VIH commence immédiatement à infecter et à endommager les cellules du corps, il existe une longue période asymptomatique (10 ans en moyenne) entre l'infection et l'apparition des symptômes. Pendant ce temps, la concentration du virus dans le sang descend à un niveau faible, mais les personnes restent contagieuses.
Au fil du temps cependant, le virus cible les cellules du système immunitaire ce qui expose le corps aux infections. Le VIH attaque spécifiquement les cellules T CD4+ qui sont des éléments importants du système immunitaire humainANCHOR. Le virus se fixe lui-même à l'extérieur des cellules T avant de les infecter. Cela entraine l'apoptose et le système immunitaire s'affaiblit progressivement jusqu'à ce que le patient attrape une infection ou un cancer ; il est alors considéré comme souffrant du SIDAANCHOR. Il est important de noter que les patients ne meurent pas du SIDA. Ils meurent d'autres maladies ou infections que l'organisme ne peut plus combattre car leur système immunitaire est affaibli.
Françoise Barré-Sinoussi et Luc Montagnier ont partagé le prix Nobel 2008 de physiologie ou médecine pour avoir découvert que le VIH était responsable du SIDA. Ils ont établi que le VIH étant un lentivirus, ce qui a permis aux scientifiques d'avoir une idée sur le comportement du VIH grâce aux travaux de recherche sur les lentivirus menés par le passé sur des animaux. Suite à l'identification rapide du virus, les responsables de la santé ont pu informer le public sur la façon de prévenir la transmission de la maladie, ce qui a au final limité la propagation du virus.
Test de dépistage du VIH
 La réponse immunitaire au VIH peut être lente, ce qui signifie que l'organisme peut mettre jusqu'à six mois pour produire des anticorps en quantité suffisante. La recherche initiale d'un test s'en est trouvée compliquée.
La réponse immunitaire au VIH peut être lente, ce qui signifie que l'organisme peut mettre jusqu'à six mois pour produire des anticorps en quantité suffisante. La recherche initiale d'un test s'en est trouvée compliquée.
La transmission du VIH aux chimpanzés de laboratoire a permis d'obtenir le premier modèle animal du VIH. Cette étape a été cruciale pour le développement de tests sanguins permettant le diagnostic et le dépistage des dons de sang. Le test utilise une technique, couramment utilisée dans d'autres domaines de l'immunologie, qui peut détecter la présence d'un anticorps spécifique. Appelé ELISA, le test consiste à appliquer des échantillons de sérum sanguin dilués sur une plaque contenant des antigènes fixés. Le test est assez sensible pour détecter d'éventuels anticorps anti-VIH (qui se lient alors aux antigènes du VIH fixés sur la plaque) même lorsqu'ils sont présents en faible concentration dans le sang. La méthode ELISA a rapidement été reconnue dans le monde entier comme un moyen efficace de dépister le VIH. Un test ELISA négatif est suffisant pour conclure que le VIH n'est pas présent dans l'échantillon, mais un deuxième test est nécessaire pour confirmer un résultat positif au test ELISA.
Tandis que la plupart des personnes produisent suffisamment d'anticorps anti-VIH pour qu'ils soient détectés par le test ELISA dans les 6 à 12 semaines, parfois (dans de rares cas), cela peut prendre jusqu'à 6 mois. En raison de cette « période fenêtre » entre l'infection et la production d'anticorps, il y a un risque d'obtenir des résultats de test faussement négatifs. Par conséquent, il est recommandé qu'une personne qui pense avoir été infectée par le VIH soit testée deux fois : trois mois après l'exposition puis de nouveau après environ six mois.
Modèles animaux du VIH
Souris BLT
La souris Moelle osseuse/Foie/Thymus ou BLT (Bone marrow-Liver-Thymus) est devenue un modèle important dans la recherche de nouveaux vaccins et traitementsANCHOR. Ayant reçu des greffes de moelle osseuse, de foie et de thymus provenant d'êtres humains, on peut considérer cette souris comme ayant un système immunitaire humainANCHOR. Elles peuvent être infectées par le VIH par voie vaginale. Elles manifestent alors de nombreux traits caractéristiques de la maladie chez les humains.
Le VIS comme modèle du VIH
Le virus de l'immunodéficience simienne (VIS) est similaire au VIH et les deux sont particulièrement enclins aux mutations, de sorte que chaque personne récupère les variations apparues dans la structure de l'ARN du VIH qu'elle transporte au cours de sa vie. La séquence d'acides aminés d'une protéine du VIH-1 portée par un individu est similaire à 95 % environ à la même protéine virale isolée chez un autre individu.
Le VIH-1 partage le plus haut degré de similitude (85 %) avec le VIS infectant le chimpanzé. On estime que le VIH-1 est issu de la mutation de cette souche de VIS avant de franchir la barrière des espèces et d'infecter les humains. D'autre part, le VIH-1 peut infecter les chimpanzés. Bien qu'il y ait eu des chimpanzés développant le SIDAANCHOR, ces cas sont très rares et, depuis le début des années 1990, les scientifiques ont renoncé à utiliser le chimpanzé comme modèle de l'infection par le VIH.
Il a vite été découvert que les macaques sont sensibles au VIS, qui cause chez cette espèce un syndrome d'immunodéficience fatal 8. Les chercheurs ont également constaté que le VIS est sensible aux mêmes médicaments que le VIH. Ils ont donc exploité ces similarités afin de développer et de tester de nombreux médicaments antiviraux, en particulier ceux utilisés en prophylaxie.
L'inconvénient avec le VIS est que la séquence de ses gènes et protéines diffère à certains endroits de celle du VIH, certains vaccins contre le VIH ne peuvent donc pas être testés directement contre le VIS. Au milieu des années 1990, les scientifiques ont pu surmonter cette difficulté et développé les SHIV, des virus génétiquement modifiés composés d'une « ossature » issue du VIS et des gènes Env, Rev, Tat, et VpuANCHOR, provenant du VIH. Alors que les premières souches du SHIV ne sont pas parvenues à déclencher le SIDA chez le macaque, de nouvelles souches pathogènes ont finalement été produites, telles que SHIV 89.6pANCHOR.
Le VIH et le SIV infectent les cellules grâce à leur interaction avec la protéine CD4 et avec une autre protéine, appelée un corécepteur, situées toutes les deux à la surface de certaines cellules T. Dans la plupart des cas d'infection précoce par le VIH-1 et le SIV, le corécepteur utilisé est CCR5, mais dans d'autres cas, il s'agit du corécepteur CXCR4ANCHOR. Plusieurs des souches de SIV, et des souches de SHIV telles que SHIV 89.6p, utilisent également le corécepteur CXCR4, une différence qui s'est avérée vitale dans la mise au point de vaccins contre le VIH.
Utilisation et développement de médicaments antirétroviraux
Contrôle du VIH chez les patients
Bien qu'il n'existe actuellement aucun traitement curatif du SIDA, il existe des traitements qui visent à ralentir l'évolution de l'infection par le VIH vers le SIDA. Les thérapies antirétrovirales, habituellement utilisées en combinaison avec d'autres traitements, ont permis de réduire le nombre de décès liés à l'infection à VIH dans le monde développé.
L'année 1986 a vu le premier essai clinique d'un médicament antirétroviral appelé l'AZT, mieux connu sous les noms de Retrovir et Retrovis. L'AZT a été étudié en recherche antirétrovirale chez la souris, avant le début de l'épidémie de SIDA, et a montré qu'il était actif contre les rétrovirus à des doses non toxiques pour les animauxANCHOR. L'activité de l'AZT contre le VIH a été rapidement confirmée chez les animaux, et en 1987 il est devenu le premier antirétroviral à être agréé par la FDA pour le traitement des maladies liées au VIH. Bientôt, d'autres médicaments antirétroviraux suivirent, plus efficaces et moins toxiques que l'AZT. Malheureusement, le virus a rapidement développé une résistance à tous ces composés, c'est la raison pour laquelle le traitement à base d'associations de médicaments est maintenant la norme.
 Une avancée majeure est venue du développement de médicaments qui inhibent l'activité de la protéase du VIH-1, une enzyme nécessaire à la formation des particules virales. Les essais cliniques sur le saquinavir ont commencé en 1991 et en 1995 il est devenu le premier inhibiteur de la protéase à être approuvé par la FDA. Lors des tests précliniques, des études in vitro avaient révélé qu'il possédait une activité anti-VIH puissante, tandis que les tests sur les animaux montraient un profil de toxicité acceptable et indiquaient que l'administration de doses cliniquement pertinentes était envisageable par voie oraleANCHOR. La publication de la structure tridimensionnelle de la protéase du VIH a guidé le développement de l'indinavir qui s'est révélé être plus puissant que le saquinavir. Plus de 150 composés tête de série et intermédiaires ont été testés au cours du développement de l'indinavir, et une fois de plus, les études de toxicité et de biodisponibilité par voie orale menées chez les animaux ont joué un rôle clé dans l'identification du composé qui est entré dans la phase des essais cliniquesANCHOR. L'indinavir est devenu rapidement un composant standard de la thérapie antirétrovirale hautement active qui a considérablement réduit la mortalité liée au SIDA dans les pays développés.
Une avancée majeure est venue du développement de médicaments qui inhibent l'activité de la protéase du VIH-1, une enzyme nécessaire à la formation des particules virales. Les essais cliniques sur le saquinavir ont commencé en 1991 et en 1995 il est devenu le premier inhibiteur de la protéase à être approuvé par la FDA. Lors des tests précliniques, des études in vitro avaient révélé qu'il possédait une activité anti-VIH puissante, tandis que les tests sur les animaux montraient un profil de toxicité acceptable et indiquaient que l'administration de doses cliniquement pertinentes était envisageable par voie oraleANCHOR. La publication de la structure tridimensionnelle de la protéase du VIH a guidé le développement de l'indinavir qui s'est révélé être plus puissant que le saquinavir. Plus de 150 composés tête de série et intermédiaires ont été testés au cours du développement de l'indinavir, et une fois de plus, les études de toxicité et de biodisponibilité par voie orale menées chez les animaux ont joué un rôle clé dans l'identification du composé qui est entré dans la phase des essais cliniquesANCHOR. L'indinavir est devenu rapidement un composant standard de la thérapie antirétrovirale hautement active qui a considérablement réduit la mortalité liée au SIDA dans les pays développés.
En 1996, la thérapie combinée, consistant à prendre des cocktails d'antiviraux simultanément, avait considérablement augmenté l'espérance de vie. Bien que ces médicaments ne soient pas un remède et doivent être pris à vie, le développement d'environ 20 antiviraux efficaces contre le VIH est considéré comme l'une des grandes réussites médicales de la fin du 20e siècle. Une étude menée en 2013 en Afrique du Sud a montré que les patients vivant avec le VIH ont une espérance de vie qui équivaut à 80 % de celle de la population générale, à condition qu'ils reçoivent des antirétroviraux à un stade suffisamment précoceANCHOR.
Prophylaxie pré-exposition
La prophylaxie pré-exposition est un traitement antirétroviral destiné à des personnes présentant un risque élevé d'infection à VIH. Cela comprend les hommes qui ont des rapports sexuels avec des hommes, les couples dont un seul partenaire est séropositif et les personnes qui ne sont pas en mesure d'insister sur l'utilisation du préservatif.
Truvada, un traitement qui associe le ténofovir et l'emtricitabine, a été approuvé aux États-Unis en 2012 pour les personnes issues de ces groupes à haut risque. Ce traitement a été testé auparavant chez les singes macaques et les souris BLT, chez lesquels il a conféré une forte protection contre le SHIV introduit par voie rectale et le VIH introduit par voie vaginale respectivementANCHOR ANCHOR.
Les résultats de l'essai clinique à grande échelle de phase III, iPrEx, publiés en 2010, ont montré que Truvada offrait aux hommes homosexuels une protection supplémentaire de 44 % contre l'infection à VIH. Le niveau de protection était plus élevé parmi ceux qui, de manière fiable, prenaient quotidiennement les pilulesANCHOR.
Prévention de la transmission
L'essai HPTN 052, mené dans le cadre du Réseau d'essais de prévention du VIH (HIV Prevention Trials Network), a étudié l'utilisation des antirétroviraux donnés aux patients séropositifs au VIH comme moyen de prévention de la transmission aux partenaires non infectés dans les relations hétérosexuelles. Les résultats, révélés en 2011, ont montré une réduction de 96 % de la transmission. C'était beaucoup plus élevé que prévu, et l'essai a été consacré comme la découverte de l'année par le magazine ScienceANCHOR. Les antirétroviraux sont connus pour réduire la quantité de virus présente dans la circulation sanguine des patients, et par conséquent, on s'attendait à ce qu'ils puissent également réduire la transmission. Toutefois, en l'absence de chiffres précis sur cet effet, les responsables de la santé publique ne pouvaient préconiser leur utilisation de cette façon au risque de voir une réduction de l'usage des préservatifs.
La recherche d'un vaccin
La nécessité d'un vaccin pour protéger les populations est évidente. Les difficultés rencontrées dans la lutte contre la propagation du VIH, en particulier en Afrique subsaharienne, combinées avec le coût élevé des médicaments antirétroviraux, ont stimulé la recherche d'un vaccin contre le VIH.
 À l'optimisme des premiers joursANCHOR a succédé la prise de conscience de l'ampleur des difficultés techniques posées par le développement d'un vaccin. Le problème réside dans le fait que, contrairement aux virus étudiés précédemment, le matériel génétique du VIH, codé sous forme d'ARN, est capable de muter rapidement. Cette caractéristique lui permet d'échapper à la réponse immunitaire car les anticorps ne peuvent reconnaître que des régions spécifiques à la surface du virus. Comme les vaccins fonctionnent en stimulant la production d'anticorps, c'est un problème important. L'enveloppe virale du VIH est également très flexible et change de forme au moment de sa fixation aux cellules T, compliquant la liaison des anticorps au virus et l'arrêt du processus. Toutefois, au cours des 25 dernières années, la recherche a dégagé plusieurs pistes sur les moyens de surmonter ces problèmes et de produire un vaccin efficace contre le VIH. Une de ces pistes s'appuie sur le fait que certaines régions du virus sont très stables et n'ont pas tendance à muter.
À l'optimisme des premiers joursANCHOR a succédé la prise de conscience de l'ampleur des difficultés techniques posées par le développement d'un vaccin. Le problème réside dans le fait que, contrairement aux virus étudiés précédemment, le matériel génétique du VIH, codé sous forme d'ARN, est capable de muter rapidement. Cette caractéristique lui permet d'échapper à la réponse immunitaire car les anticorps ne peuvent reconnaître que des régions spécifiques à la surface du virus. Comme les vaccins fonctionnent en stimulant la production d'anticorps, c'est un problème important. L'enveloppe virale du VIH est également très flexible et change de forme au moment de sa fixation aux cellules T, compliquant la liaison des anticorps au virus et l'arrêt du processus. Toutefois, au cours des 25 dernières années, la recherche a dégagé plusieurs pistes sur les moyens de surmonter ces problèmes et de produire un vaccin efficace contre le VIH. Une de ces pistes s'appuie sur le fait que certaines régions du virus sont très stables et n'ont pas tendance à muter.
Plusieurs données probantes indiquent que l'élaboration d'un vaccin efficace n'est pas une tâche impossible : les anticorps humains peuvent neutraliser le VIH dans les modèles animauxANCHOR, certaines personnes affichent des réponses immunitaires qui sont en mesure de contrôler le virus pendant des années sans développer le SIDA, et enfin, certains vaccins sont efficaces contre le VIS chez le macaqueANCHOR.
Approches de développement d'un vaccin
Vaccin vivant atténué
De nombreuses approches ont été étudiées pour trouver un vaccin efficace contre le VIH. Une approche consiste à développer un vaccin vivant atténué, ce qui implique le recours à des formes du virus vivant qui ont été modifiées, soit génétiquement, par mutation de sites spécifiques sur l'ARN, soit par d'autres moyens, les rendant ainsi incapables de provoquer une maladie. Ce type de vaccin simule mieux l'infection naturelle à VIH que les virus inactivés, et génère une bonne réponse immunitaire. Les vaccins atténués contre le VIS ont connu un succès mitigé chez le macaque au cours d'études difficiles où ils sont exposés au VIS après inoculation. Les animaux ont été correctement protégés dans certaines étudesANCHOR, contrairement à d'autresANCHOR. Malheureusement, les vaccins vivants atténués contre le VIS ont eux-mêmes causé le SIDA lorsqu'ils étaient administrés à des bébés macaques. De plus, le suivi à long terme des macaques adultes a montré que, là encore, le vaccin vivant avait parfois entrainé le SIDAANCHOR, rendant cette approche inadaptée pour des essais sur l'homme. Bien que décevants, ces résultats n'en ont pas moins fourni la preuve qu'il était possible de stimuler une réponse immunitaire qui pouvait empêcher l'infection à VIH/VIS.
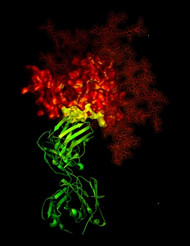
Image radiocristallographique montrant l'anticorps neutralisant b12 (ruban vert) en contact avec une structure cible (jaune), cruciale aux développeurs de vaccin, sur la protéine gp120 (rouge) du VIH. © NIH
Protéines de l'enveloppe virale
Les vaccins vivants atténués apparaissant peu prometteurs, d'autres techniques de vaccination ont été étudiéesANCHOR. L'approche classique de développement d'un vaccin est d'utiliser une forme inactivée du virus, ou une partie du virus, telle que l'enveloppe virale de protéines, pour induire une réponse immunitaire humorale productrice d'anticorps. Ceux-ci reconnaissent le virus et évitent ainsi l'infection de l'organisme. L'enveloppe extérieure du virus, composée de protéines gp120, était une cible évidente. Une forme purifiée a été développée en vue d'une utilisation comme vaccin. AIDSVAX, un des premiers vaccins composés de sous-unités gp120, a été en mesure de bloquer une infection à faible dose par la souche VIH-1 IIIB se liant au corécepteur CXCR4 chez le chimpanzé ; il est donc passé au stade des études cliniques chez l'homme. Malheureusement, le vaccin AIDSVAX n'a pas apporté une protection suffisante au cours des essais cliniquesANCHOR, un échec qui n'a pas vraiment surpris puisqu'antérieurement, il n’avait pas réussi à prévenir l'infection par une souche pathogène VIS se liant au corécepteur CCR5 chez le macaque. Les efforts pour développer des vaccins reposant sur les sous-unités se sont poursuivis, mais la plupart des résultats contre les souches VIS se liant au corécepteur CCR5 ont été décevants, avec au mieux, l'obtention d'une protection partielle contre les souches VIS homologuesANCHOR.
Vaccins ADN
La technologie des vaccins recombinants vivants, ou ADN, fait appelle à un autre virus pour le transfert de gènes du VIH ou VIS dans les cellules. L'infection de ces cellules est ensuite « reconnue » par le système immunitaire, qui déclenche une réponse immunitaire. Contrairement à la réponse humorale, stimulée par un vaccin composé de sous-unités, les vaccins recombinants vivants stimulent les cellules T cytotoxiques, un type de lymphocyte qui n'exprime pas le récepteur CD4 utilisé par le VIH pour pénétrer les cellules. Ce type de lymphocyte ne peut donc pas être infecté par le VIHANCHOR. Le rôle normal de ces cellules dans le corps est de contrôler une infection virale et de tuer les cellules infectées par le virus avant que celui-ci ne commence à se multiplier. Il semble bien établi que ces cellules contrôlent le VIH au cours des premiers stades de l'infection, empêchant le développement du SIDA, souvent pendant de nombreuses années. Les études chez le macaque ont montré que la capacité des vaccins à stimuler les lymphocytes T cytotoxiques a un impact sur la propagation de l'infection en réduisant la charge virale. Les lymphocytes T cytotoxiques attaquent seulement les cellules qui contiennent des virus. Ils n'empêchent donc pas l'infection, mais ils réduisent l'impact du virus sur le système immunitaire, et une faible charge virale peut prévenir la transmission et réduire la propagation de la maladie.
Les essais STEP et Phambili sur le vaccin MRK-Ad5
Le vaccin MRK-Ad5 a été considéré comme une avancée prometteuse et son parcours préclinique et clinique a été étroitement surveillé. Après une première étape de développement, accompagnée de tests sur les animaux et d'analyses in vitro, et les premières études cliniques, il a été retiré de la phase IIb des essais cliniques en 2007ANCHOR.
Le vaccin MRK-Ad5 se composait de 3 gènes du VIH, transportés dans le corps par un virus du rhume fréquent, l'adénovirus-5, utilisé comme vecteur. Il était prévu que les principaux gènes du VIH transportés par le virus suffiraient à accorder l'immunité contre le VIH, permettant aux lymphocytes T de l'organisme de détecter puis de tuer les cellules contenant le virus, sans que les gènes du VIH, ou l'adénovirus transporteur, puissent provoquer une maladie.
Bien qu'au cours des études menées sur les animaux, il n'avait pas induit la production d'anticorps protecteurs, il avait cependant stimulé fortement les lymphocytes T cytotoxiques et l'on espérait qu'il serait donc capable de réduire la charge virale chez les personnes infectées par le VIH, et peut-être même de faire baisser les taux d'infection. Le deuxième ensemble d'essais de phase II avait été conçu pour tester l'efficacité du vaccin. Deux essais distincts ont été menés, l'un, appelé STEP, a eu lieu en Amérique et en Australie, tandis que le deuxième, nommé Phambili, s'est déroulé en Afrique du Sud.
Les premières analyses des résultats de l'essai STEP montraient que sur 741 personnes ayant reçu une dose unique du vaccin, 24 avaient été infectées par le VIH. Parallèlement, sur les 762 personnes qui ont reçu le placebo, 21 avaient été infectées par le VIH. Bien que ces résultats n'aient pas été statistiquement significatifs, d'autres analyses ont été effectuées qui ont révélé une augmentation de la probabilité d'infection dans un groupe particulier de volontaires masculins.
Les volontaires masculins, qui avaient déjà une forte immunité contre l'adénovirus-5 avant la vaccination, semblaient avoir un risque d'infection à VIH plus élevé une fois qu'ils avaient reçu le vaccin (21 des 392 hommes qui affichaient des niveaux élevés d'anticorps dirigés contre l'adénovirus, ils n'étaient que 9 sur 386 dans le groupe contrôle). D'autres vaccins similaires mais qui utilisent des adénovirus différents sont maintenant en cours de développement ANCHOR, il est donc important de bien comprendre les problèmes rencontrés avec le vaccin MRK-Ad5.
Une analyse ultérieure des deux essais suggère que le vaccin aurait augmenté le risque d'infection de 41 %. Toutefois, certains scientifiques se sont interrogés sur l'étendue réelle de l'effet car ce chiffre inclut les infections à VIH qui se sont produites après la levée de l'insu. De ce fait, le risque est grand que ceux qui ont découvert qu'ils avaient reçu le vaccin aient été plus susceptibles de s'engager dans des comportements sexuels imprudentsANCHOR.
Le vaccin MRK-Ad5 avait été pleinement développé et largement étudié chez les primates non humains avant le début des essais sur l'homme. Après avoir reçu un vaccin similaire au MRK-Ad5, des macaques ont été infectés avec SHIV 89.6p, un hybride du VIS, génétiquement modifié pour contenir des gènes du VIH. Bien que les singes vaccinés n'aient pas été protégés contre l'infection à SHIV, leur charge virale était plus faible que celle associée aux singes non vaccinés et ils n'avaient pas développé le SIDA.
La décision de procéder à des essais cliniques avec MRK-Ad5 a été critiquée à l'époque par les scientifiques, préoccupés par la fiabilité de SHIV 89.6p en tant que modèle de l'infection à VIH. En effet, SHIV 89.6p utilise une stratégie d'infection des cellules du système immunitaire différente de celle observée dans l'infection à VIHANCHOR. Et surtout, MRK-Ad5 n'est pas parvenu à prévenir l'infection ou à influencer la progression de la maladie chez le macaque exposé à SIVMAC239, une souche de VIS qui utilise CCR5 et un cycle d'infection correspondant étroitement à ce qui se passe dans la majorité des cas d'infection à VIHANCHOR ANCHOR.
La marche à suivre
Il y a désormais, dans la communauté de chercheurs travaillant sur l'élaboration d'un vaccin contre le VIH, une prise de conscience générale que la barre de passage aux essais cliniques a été placée trop bas, en raison d'une part de l'urgence légitime d'obtenir des vaccins candidats aux essais cliniques, et d'autre part, en raison des résultats décevants recueillis aux tests réalisés sur les souches de VIS strictes. Dans plusieurs recommandationsANCHOR ANCHOR ANCHOR existe un consensus général qui stipule qu'avant de passer aux essais cliniques, un vaccin candidat doit :
– démontrer son efficacité contre des virus provocateurs stricts tels que SIVMAC239 et SIVMAC251 ;
– démontrer son efficacité chez les singes rhésus dépourvus des allèles MHC associés à un contrôle viral efficace (Mamu-A*01, Mamu-B*17, Mamu-B*08) ;
– démontrer son efficacité dans les tests de provocation par des souches homologues et hétérologues du VIS ;
– cibler le virus efficacement au début de l'infection des muqueuses ;
– stimuler les deux types de réponses immunitaires, humorale et à médiation cellulaire
Il y a toujours un besoin urgent de nouveaux traitements pour contrôler le VIH et il est clair que la recherche fondamentale doit se poursuivre. Le prime-boost (amorce-rappel) est une approche qui a été beaucoup étudiée au cours de la décennie écoulée. La première étape de cette stratégie est une immunisation avec un vaccin ADN, suivie quelques mois plus tard par un rappel de vaccination avec administration de sous-unités protéiques. L'objectif est de stimuler une réaction immunitaire plus forte, impliquant à la fois les anticorps et les cellules T.
Références
- http://www.nytimes.com/1981/07/03/us/rare-cancer-seen-in-41-homosexuals.html
- 80 Days That Changed the World: A Name for the Plague July 27, 1982 http://content.time.com/time/specials/packages/article/0,28804,1977881_1977895_1978703,00.html
- Garg H, Mohl J, Joshi A (2012) HIV-1 induced bystander apoptosis Viruses 4(11):3020-43 doi: 10.3390/v4113020
- Cummkins NW and Badley AD (2010) Mechanisms of HIV-associated lymphocyte apoptosis: 2010 Cell Death and Disease 1, e99 doi: 10.1038/cddis.2010.77
- Shultz LD et al (2012) Humanized mice for immune system investigation: progress, promise and challenges Nat Rev Immunol. 12(11):786–798 doi:10.1038/nri3311
- Melkus MW et al (2006) Humanized mice mount specific adaptive and innate immune responses to EBV and TSST-1 Nature Medicine 12(11):1316-22 doi:10.1038/nm1431
- Novembre, FJ et al (1997) Development of AIDS in a chimpanzee infected with human immunodeficiency virus type 1 J Virol 71(5):4086-4091
- Brenchley JM et al (2004) CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract J Exp Med. 200(6):749-759
- Feinberg MB and Moore JP (2002) AIDS vaccine models: Challenging challenge viruses Nature Medicine 8:207-210
- Feinberg MB and Moore JP (2002) AIDS vaccine models: Challenging challenge viruses Nature Medicine 8:207-210
- Mitsuya, H et al (1985) 3’-Azido-3’-deoxythymidine (BW A509U): an antiviral agent that inhibits the infectivity and cytopathic effect if human T-lymphotropic virus type III/ lymphadenopathy-associated virus in vitro, Proc. Natl. Acad. Sci. USA. 82,
- Duncan IN and Redshaw S (2001) Discovery and early development of Saquinavir, in Ogdon RC and Flexner CW ed, Protease inhibitors in AIDS therapy, Informa HealthCare, London, pages -48
- Dorsey BD et al. (1994) L-735,524: the design of a potent and orally bioavailable HIV protease inhibitor. J. Med. Chem., 37, 3443-3451.
- Johnson LF et al (2013) Life Expectancies of South African Adults Starting Antiretroviral Treatment: Collaborative Analysis of Cohort Studies PLoS Medicine 10(4):e1001418 doi:10.1371/journal.pmed.1001418
- Cohen MS and Kashuba AD (2008) Antiretroviral Therapy for Prevention of HIV Infection: New Clues From an Animal Model. PLoS Medicine 5(2):20 doi:10.1371/journal.pmed.0050030
- Denton PW et al (2008) Antiretroviral Pre-exposure Prophylaxis Prevents Vaginal Transmission of HIV-1 in Humanized BLT Mice. PLoS Medicine 5(1): e16 doi:10.1371/journal.pmed.0050016
- Grand RM et al (2010) Preexposure chemoprophylaxis for HIV prevention in men who have sex with men The New England Journal of Medicine 363:2587-2599 doi:10.1056/NEJMoa1011205
- http://www.sciencemag.org/content/334/6063/1628.full
- Statement issued 27th Feb 1986 by W. Dowdle, AIDS coordinator of the Public Health Service, Public Health Reports
- Gauduin MC et al (1997) Passive immunization with a human monoclonal antibody protects hu-PBL-SCID mice against challenge by primary isolates of HIV-1. Nat Med 3 (12) 1389-93.
- Hu SL et al (1992) Protection of macaques against SIV infection by subunit vaccines of SIV envelope glycoprotein gp160, Science 255 (5043) 456-459.
- Connor RI et al (1998). Temporal Analyses of Virus Replication, Immune Responses, and Efficacy in Rhesus Macaques Immunized with a Live, Attenuated Simian Immunodeficiency Virus Vaccine. J Virol, 72, 7501-7509.
- Lewis MG et al (1999) Limited Protection from a Pathogenic Chimeric Simian-Human Immunodeficiency Virus Challenge following immunization with Attenuated Simian Immunodeficiency Virus. J Virol, 73, 1262-1270.
- Baba, TW et al. (1999) Live attenuated, multiply deleted simian immunodeficiency viruscauses AIDS in infant and adult macaques. Nature Medicine 5:194–203.
- Girard MP, Osmanov SK, and Kieny MP (2006)A review of vaccine research and development: the human immunodeficiency virus (HIV) Vaccine 24(19):4062-4081.
- Brenchley JM et al (2004) CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract J Exp Med. 200(6):749-759
- Girard MP, Osmanov SK, and Kieny MP (2006)A review of vaccine research and development: the human immunodeficiency virus (HIV) Vaccine 24(19):4062-4081.
- Girard MP, Osmanov SK, and Kieny MP (2006)A review of vaccine research and development: the human immunodeficiency virus (HIV) Vaccine 24(19):4062-4081.
- http://www.hvtn.org/media/pr/step1207.html
- http://www.nature.com/news/hiv-vaccine-raised-infection-risk-1.13971
- http://www.nature.com/news/hiv-vaccine-raised-infection-risk-1.13971
- Veazey RS et al. (1998) Gastrointestinal tract as a major site for CD4+ T cell depletion and viral replication in SIV infection, Science, 280 427.
- Allen TM et al. (2002) Effects of cytotoxic T lymphocytes (CTL) directed against a single simian immunodeficiency virus (SIV) Gag CTL epitope on the course of SIVmac239 infection. J Virol. 76(20):10507-10511.
- Casimiro, DR et al. (2005)Attenuation of simian immunodeficiency virus SIVmac239 infection by prophylactic immunization with DNA and recombinant adenoviral vaccine vectors expressing Gag. J. Virol. 79:15547–15555.
- Morgan C et al. (2008) The use of nonhuman primate models in HIV vaccine development. PLoS Medicine 12;5(8):e173
- Barouch DH (2008) Challenges in the development of an HIV-1 vaccine. Nature 455(7213):613-619
- Hasse AT (2010) Targeting early infection to prevent HIV-1 mucosal transmission Nature 464(7286):217-223
Last edited: 23 September 2014 16:19
